Beranda
/
Chemistry
/
Suatu gas memiliki volume 56L pada suhu 0°C dan tekanan 1 atm. Gas tersebu memiliki massa 175 gram. Jika rumus empiris senyawa adalah CH_(2) . Rumus molekulnya adalah.... A CH_(3) B C_(6)H_(12) C C_(5)H_(10) D C_(4)H_(8) E C_(5)H_(12)
Pertanyaan
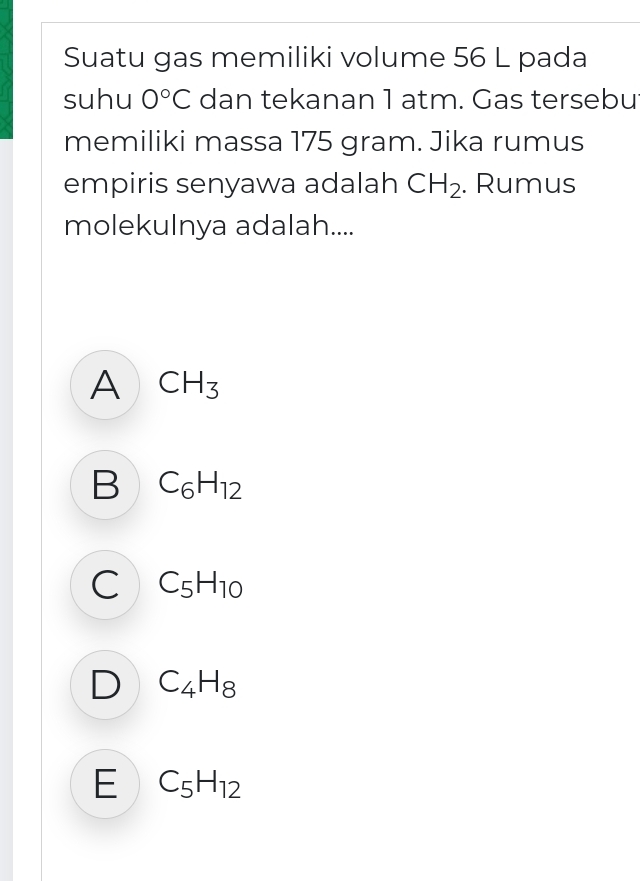
Suatu gas memiliki volume 56L pada suhu 0°C dan tekanan 1 atm. Gas tersebu memiliki massa 175 gram. Jika rumus empiris senyawa adalah CH_(2) . Rumus molekulnya adalah.... A CH_(3) B C_(6)H_(12) C C_(5)H_(10) D C_(4)H_(8) E C_(5)H_(12)
143
Jawaban
4.0(205 suara)
Wati Kartinielit · Tutor selama 8 tahun
Jawaban
D C4H8</p><br /><p>
Penjelasan
Soal ini berkaitan dengan konsep hukum gas ideal dan molekul senyawa. Gas dengan rumus empiris CH2 memiliki molekul bahwa setiap molar gas pada STP mempunyai volume 22,4 liter.<br /><br />Langkah-langkah penyelesaian soal adalah sebagai berikut:<br /> <br />1. Hitung jumlah mol gas yang ada: volume/volume yang masing-masing mol gas ideal pada STP = 56 liter / 22,4 liter/mol = 2,5 mol. Massa molekul adalah massa total yang diketahui dibagi molinya, yaitu 175 gram/2,5 mol = 70 g/mol.<br /><br />2. Ditemukan bahwa massa molekul dari rumus empirisnya (lebih dikenal sebagai massa molar impiris), dimana 1 atom karbon (C) berkontribusi 12 massa atom dan 2 atom hidrogen (H) memberikan massa atom 1, maka total menjadi 14 g/mol.<br /><br />3. Rumus molekul dapat ditentukan dengan membagi masa molekul yang didapat sebelumnya dengan massa dar rumus empiris dan didapatkan bahwa tiap mol dari senyawa memiliki 5 gugus CH2. Sehinga rumus molekul senyawa gas tadi adalah C5H10 (alternatif jawaban C).</p>
Apakah jawabannya membantu Anda?Silakan beri nilai! Terima kasih
